| J Korean Neurol Assoc > Volume 34(4); 2016 > Article |
|
Abstract
Posterior reversible encephalopathy syndrome (PRES) is a neurotoxic state with distinct clinical and radiological features. It is characterized by headache, vomiting, altered mentality, seizures, and visual disturbances. PRES typically consists of reversible vasogenic edema in the posterior circulation territories, although irreversible cytotoxic edema and atypical lesion locations have also been described. Most patients are markedly hypertensive at presentation, although some have only mildly elevated or even normal blood pressure. Many known causative factors of PRES have been elucidated, but its underlying pathophysiology remains poorly defined. This review summarizes the etiologies, presumed pathophysiology, histopathologic findings, basic and advanced imaging features, clinical symptoms of presentation, and treatment of PRES.
고혈압뇌병증, 자간 또는 장기이식 후 사이클로스포린(cyclosporine) 치료를 받은 환자에서 두통, 경련, 시력소실 혹은 의식저하 같은 신경계증상이 발생하였다가 7일가량 지나면 대부분 회복되고, 뇌영상검사에서 양쪽 후두두정측두엽에 가역뇌병변이 나타난 증례들이 보고되었다. Hinchey 등[1]은 이러한 환자에서 주로 후방 대뇌백질에 국한된 혈관부종이 발생하고 추적 뇌영상검사에서 대부분의 병변이 사라지는 것을 확인한 후에 가역후백질뇌병증(reversible posterior leukoencephalopathy syndrome)으로 명명하였다. 이후 Casey 등[2]은 뇌백질뿐만 아니라 피질에도 병변이 관찰되었기 때문에 가역후뇌병증(posterior reversible encephalopathy syndrome, PRES)으로 개명하였다. 물론 PRES에서 혈관부종뿐만 아니라 세포독부종이 관찰되는 경우도 많고, 이 가운데 일부는 추적검사에서 뇌경색으로 진행하기 때문에 반드시 가역적인 것은 아니다[3-7]. 아울러 대뇌 후방뿐만 아니라 전두엽, 뇌간, 소뇌, 기저핵 또는 시상에도 병변이 발생하기 때문에 PRES라는 명칭이 적절한지에 대한 논란이 있다[2,4-7].
PRES는 여러 질환에 의하여 유발되고 임상증상이 비특이적이며 발생기전이 아직 명확하게 밝혀지지 않았지만 자기공명영상(magnetic resonance imaging, MRI)에서 특징적인 병변이 발견되면 쉽게 진단할 수 있으며 국내에서도 가역후백질뇌병증 혹은 가역후뇌병증으로 여러 증례를 보고하였다. 이 종설에서는 문헌고찰을 통하여 PRES의 원인, 발생기전, 병리소견, 임상양상, 영상소견, 치료와 예후에 대하여 자세히 알아보고자 한다.
연구대상에 따라서 원인질환의 빈도가 다르지만 고혈압이 가장 흔하여 PRES 환자의 약 75%에서 동반되고 25%에서는 혈압이 정상이거나 약간 상승되어 있다[1,2,4-9]. 장기이식 후 면역억제제에 의한 경우가 다음으로 흔한데 사이클로스포린과 타크로리무스(tacrolimus)가 대표적이다(Table 1). 면역억제제뿐만 아니라 항암제도 PRES를 유발할 수 있는데 고용량을 투여하거나 여러 가지 약물을 동시에 투여할 때 발생빈도가 높은 것으로 알려져 있다[7]. 전신홍반루푸스, 결절다발동맥염, 피부경화증, Wegener 육아종증, 혈전혈소판감소자색반병 같은 자가면역질환과 자간 또는 신장질환에서도 PRES가 발생한다[1,2,4-7].
감염, 폐혈증 또는 쇼크 환자에서도 PRES가 발생할 수 있는데 86%가 그람양성균이었고 40%에서는 혈압이 정상 혹은 약간 상승되었다[10]. Cyclosporine 치료 중에 저콜레스테롤혈증이 발생하였던 환자, 갑상선기능항진증에 의한 고칼슘혈증이나 저마그네슘혈증 환자에서도 발생하였으므로 혈중 전해질농도와 콜레스테롤을 확인하여야 한다. 이 밖에 급성간헐포르피린증, 수혈, 알코올중독 혹은 알코올금단, 자율신경 침범에 의하여 급성 고혈압이 발생한 길랭-바레증후군, 면역글로불린요법을 받은 길랭-바레증후군, 만성신부전으로 투석을 받는 환자에게 에리트로포이에틴요법, 벌침치료 또는 췌장염 등에 의한 경우도 있었다.
PRES의 발병기전은 아직도 명확하게 규명되지 않았으며 중요한 세 가지 가설은 다음과 같다.
현재까지 가장 유력한 가설이며 고혈압과 자간 환자에서 PRES가 많이 발생하기 때문에 제시되었던 기전이다. 뇌혈관자동조절의 범위를 벗어나는 수준까지 혈압이 상승하면 세동맥이 확장되어 모세혈관망에 과관류가 초래되고 이어서 적혈구, 거대분자 및 액체가 혈관 밖으로 유출되어 혈관부종이 발생한다는 가설이다[11,12].
일반적으로 피질은 혈액뇌장벽이 치밀하게 연결되어 있기 때문에 부종이 잘 생기지 않는데 PRES에서는 부종이 피질에서 먼저 시작되고 이어서 피질하백질까지 파급된다[2]. 초기 연구에서 PRES의 병변이 주로 피질하백질에 발생된다고 오인하였는데 이것은 시간이 경과하였거나 중등도 이상의 PRES 환자에서 주로 피질하백질에 병변이 나타났기 때문이다. 두정엽과 후두엽에는 혈관의 교감신경이 적게 분포하기 때문에 이 부위에 병변이 잘 생기는 것으로 추정된다[13]. PRES 환자에서 고혈압이 동반되는 경우가 많고 고혈압을 치료하면 증상이 호전되고 뇌관류영상에서 과관류가 확인되었던 증례[14]가 있었는데 이는 과관류 가설을 뒷받침하고 있다.
PRES의 발생기전에 대한 초기 가설인데 혈압이 상승하면 뇌혈관자동조절기능에 의하여 뇌혈관이 수축된다. 과도한 뇌혈관의 수축으로 인하여 뇌조직에 허혈이 발생하면 혈액-뇌장벽이 손상되고 혈관부종과 점상출혈이 발생한다는 가설인데 경계부위(watershed)에 이러한 손상이 심하게 발생하였다[19]. 자간/전자간 환자의 뇌혈관촬영에서 큰 뇌혈관의 수축이 발견되었기 때문에 이러한 가설이 제기되었다[20]. 일부 환자에서 허혈과 뇌경색이 발견되었고 최근에는 임신중독 환자의 단일양자방출단층촬영에서 관류저하를 확인하였으며 MR (magnetic resonance) 관류영상에서도 관류저하가 있었는데 이러한 결과는 저관류 이론을 뒷받침한다[15,18]. 그러나 고혈압이 없는 환자에서 PRES가 발생하는 것과 T세포 활성과 시토카인 방출현상은 관류저하로 설명할 수 없다[7].
과관류 혹은 관류저하 단독으로 PRES의 병태생리를 정확하게 설명하기 어렵다. 최근에 분자생물학의 발달에 힘입어 ‘혈관내피 손상’이라는 새로운 가설이 제기되었는데 혈관내피손상은 여러 원인에 의한 PRES에서 공통적으로 나타나는 현상이며 면역반응에 의하여 혈액뇌장벽 손상이 발생하는 병리기전이다(Fig. 1).
사이클로스포린과 타크로리무스 혹은 항암제와 같은 독성물질에 노출되거나 자가면역질환, 자간, 감염/폐혈증/쇼크 또는 장기이식과 같은 상황에서는 혈관내피가 활성화되어 종양괴사인자-α(TNF-α), 인터루킨-1(IL-1) 또는 인터페론-γ와 같은 시토카인, 케모카인, 집락자극인자(colony stimulating factors) 혹은 엔도텔린(endothelin)을 분비하고 면역체계(T세포)가 활성화된다[16,21-24]. 혈관내피에서 분비되는 엔도텔린은 강력한 혈관수축제이므로 혈압을 상승시키고 뇌혈관을 수축시켜 조직의 허혈을 유발할 수 있다. TNF-α와 IL-1은 세포간부착분자-1 (intercellular adhesion molecule-1, ICAM-1)과 혈관세포부착분자-1 (vascular cell adhesion molecule-1, VCAM-1)의 발현을 증가시키고 이는 백혈구와 반응하여 활성산소(reactive oxygen species)와 단백분해효소를 발생시킴으로써 혈관내피가 손상된다[22]. 아울러 TNF-α와 IL-1은 성상세포에 작용하여 혈관내피성장인자(vascular endothelial growth factor, VEGF)의 생산을 증가시키는데 혈관내피성장인자는 뇌혈관의 치밀이음부(tight junction)를 약화시키고 수포공포소기관(vesiculo-vacuolar organelle)을 활성화시켜 부종을 일으킨다. 이러한 혈관내피 기능저하설이 PRES의 발병기전과 부합되고 고혈압이 동반되지 않는 경우, 독성물질 또는 자가면역질환에 의하여 PRES가 발생하는 것도 설명이 가능하다[4,6,7].
이러한 과정은 혈압의 변화에 의하여 영향을 받을 수 있는데, 혈압이 상승하면 뇌혈관자동조절기능이 과민하게 반응하여 혈관이 심하게 수축된다. 그래서 고혈압을 치료하면 혈관수축 자동조절기능이 감소하여 혈관이 확장됨으로써 관류가 개선될 수 있다[16]. 아울러 혈액뇌장벽이 손상되면 조영증강이 일어날 수 있는데 이것 역시 혈관내피의 기능저하를 시사한다.
혈관내피의 손상과 혈관의 수축은 뇌관류를 감소시켜서 뇌조직의 저산소증을 초래하고, 저산소증으로 인하여 저산소증유발인자 1-α (hypoxia-induced factor 1-α)가 발현되면 VEGF가 더욱 증가되어 치밀이음부가 약화되어 부종이 악화된다. 미세혈관의 내피가 손상되거나 수축하면 적혈구가 손상을 받거나 파괴될 수 있으며(미세혈관병증용혈), 실제로 다양한 원인에 의한 PRES에서 미세혈관병증용혈이 확인되었다[24].
PRES 환자의 3/4에서 고혈압이 동반되지만 PRES를 유발하는 중요 원인이라기보다는 PRES를 유발하는 병리기전에 의한 결과로 보아야 한다는 주장이 제기되었다[24]. 첫째, 혈관내피의 기능저하로 인하여 혈관확장제인 산화질소(nitric oxide)의 생성이 감소하면 혈관이 수축하여 혈압이 상승할 수 있으며 혈관영상에서 보이는 혈관수축의 원인이 될 수 있다. 둘째, 혈관내피의 활성화로 인하여 엔도텔린이 분비되면 혈관의 수축이 발생하고 혈관에 세포 유착이 증가하는데 이로 인하여 혈압이 상승할 수 있다.
급성기에 조직생검을 하였던 보고에 의하면 병변에 내피세포의 활성화, 광범위한 혈관부종, 반응성 성상세포 또는 반응성 소교세포가 나타났지만 염증반응은 없었다[25]. CD4와 CD8을 포함하는 비특이적 T세포의 부착은 발견되었으나 B세포, 다형핵백혈구, 단핵구, 대식세포 또는 임파구 침윤은 없었다. 혈관의 손상에 대한 보고도 있었는데 간이식 환자의 조직생검에서 혈관염증과 같은 급성 혈관병이 나타났다[26].
급성기를 지나고 상당한 시간이 경과한 후에 하였던 부검결과에 의하면 병변 부위에 탈수초, 허혈, 신경세포손상, 층형태(laminar) 괴사 혹은 출혈이 발견되었다. 혈관에는 내막비후, 부분 협착, 내막 박리, 기질화혈전(organized thrombus)이 보였다[27].
젖산탈수소효소(lactate dehydrogenase, LDH)는 뇌, 신장, 간, 폐, 심근, 비장, 적혈구, 백혈구 혹은 혈소판에 분포한다. 세포 내에 주로 분포하기 때문에 혈청보다 세포 내에서 농도가 500배 가량 높다. PRES 환자에서 뇌조직의 손상 혹은 용혈이 발생하면 LDH 혈청농도가 상승하기 때문에 생물표지자로 사용할 수 있다[28,29]. 자간 또는 전자간 환자에서 LDH의 혈청농도와 뇌부종 사이에는 상관관계가 없었지만[30] PRES 증상이 발생하기 전에 LDH 혈청농도가 먼저 상승하므로 PRES 발생을 예측하는 데 도움이 될 수 있다[30,31]. 혈관내피 활성의 표적자인 ICAM-1과 VCAM-1뿐만 아니라 TNF-α와 VEGF도 PRES의 생물표지자로 사용될 수 있으나 현실적으로 임상에서 활용하기는 부적절하고 연구에 주로 이용된다[24].
대규모 연구결과에 의하면 발생빈도는 자간 혹은 전자간에 의하여 여성에서 약간 많은 편이고 50대 중반에 호발한다[5,6,9,32-34]. 대부분 환자에서 임상증상은 비특이적이며 병변 위치와 정도에 따라서 다를 수 있다. 경련이 발생하면 급성으로 발현하지만 경련이 동반되지 않으면 며칠에 걸쳐서 서서히 의식저하를 보이는 아급성으로 시작된다[5,6].
가장 흔한 초기 증상인 발작은 43-92%에서 발생하는데 첫 24시간 이내에 발생하는 전신강직간대발작이 대부분이며 약 2/3에서 단발성이었다. 뇌전증지속상태는 드물지만 Fugate 등[6]의 연구에 의하면 18%에서 발생하였는데 뇌병변의 범위와 정도와는 상관관계가 없었다. 그리고 발작이 발생하였던 대부분의 환자에서 피질 침범이 없었기 때문에 발작과 피질 병변은 연관성이 없는 것으로 볼 수 있다. 급성기에 발작이 발생하더라도 만성적인 뇌전증으로 이행하는 경우는 거의 없는 것으로 나타났지만[35] 뇌경색 또는 뇌출혈의 동반 여부에 따라서 차이가 있을 것으로 추정된다. 뇌파에서 국소 극파가 나타날 수 있지만 드문 것으로 알려져 있다.
전형적인 병변은 뇌의 후방부에 좌우 비대칭 혹은 대칭으로 피질, 피질하백질 또는 심부백질에 발생하는 혈관부종이다(Fig. 2). T2-강조영상, 액체감쇠역전회복(fluid attenuation inversion-recovery, FLAIR) 영상, 겉보기확산계수지도에서는 고신호강도로 나타나고 확산강조영상에서는 동신호강도로 나타난다[1,2,4]. 세포독성부종이 동반되면 확산강조영상에서 고신호강도, 겉보기확산계수지도에서는 저신호강도로 나타난다. 세포독성부종과 조영증강은 흔하지 않으며 있더라도 일부분에 국한된다. 혈관부종은 시간이 지나면서 대부분 저절로 좋아진다.
초기에는 피질이 손상되고 시간이 경과하면서 심부백질이 침범되기 때문에 MRI 촬영시점과 정도에 따라서 병변의 위치가 다를 수 있다[2]. 경미한 경우에는 주로 피질에 병변이 나타나지만 중등도인 경우에는 부종이 피질뿐만 아니라 피질하백질과 심부백질에도 나타되고 심한 경우에는 피질에서 뇌실 주변부에 이르기까지 혈관 부종이 광범위하게 생길 수도 있다. 과거 연구에서는 시간이 경과한 후에 혹은 증상이 심한 경우에 MRI를 촬영하였기 때문에 피질하백질에만 병변이 발생하는 것으로 오인되었다. 부종이 심하거나 출혈이 동반되어 뇌척수액경로를 압박함으로써 수두증을 유발하거나, 종괴효과로 인하여 중심선 이동(midline shift) 또는 이차적인 뇌탈출이 발생할 수도 있다[2,7,36].
병변 위치는 두정후두엽(94-98%)이 가장 흔하고 전두엽(77-79%), 측두엽(64-68%), 소뇌(33%), 뇌간(12-20%), 기저핵(12-20%)의 순서이며 뇌간과 기저핵이 모두 침범되는 경우는 10% 가량되고 자가면역질환에서는 소뇌침범이 유의하게 많았다[1,6,8]. 패혈증 혹은 감염 환자에서는 피질침범이 유의하게 많았다[6]. 병변의 위치와 범위는 고혈압 또는 자간의 유무와 상관관계가 없는 것으로 나타났지만[6,37] 자간 환자에서 병변의 숫자가 더 많고 기저핵 침범이 더 많았다는 보고가 있었다[37].
Bartynski [4]는 MRI 결과를 분석하여 대뇌반구를 침범하는 유형에 따라서 3가지로 나누었다. 첫째, 두정엽과 후두엽에만 병변이 국한되는 특징적이고 전형적인 유형인데 실제로 22%에 불과하였다(Fig. 2). 둘째, 상전두구(superior frontal sulcus) 유형은 27%를 차지하였는데 상전두구의 중반부와 후반부 피질, 피질하백질과 심부백질에 병변이 발생하는데 전두극 부분은 침범하지 않았다(Fig. 3). 셋째, 전반구분수계(holohemispheric watershed) 유형은 23%에서 나타났는데 전두엽, 두정엽 그리고 후두엽의 분수계에 병변이 나타났다(Fig. 4). 이러한 3가지 유형에서도 병변이 일부분 혹은 비대칭으로 나타나기도 하고 두 가지 유형이 혼재되어 있는 경우도 있다.
최근에 비전형적인 PRES를 보고하였는데 4-5%에서는 전형적인 뇌 후방부 병변 없이 뇌간, 기저핵, 시상, 소뇌 또는 뇌실주위 백질에 병변이 있었다(central-variant PRES) (Fig. 5)[2,8,38-42]. 두정엽-후두엽에 전형적인 병변이 있으면 진단에 어려움이 없지만 뇌간, 기저핵 또는 시상과 같은 중심영역에만 병변이 있는 경우에는 진단이 어려울 수 있다[4]. 이 외에 후방 속섬유막과 섬(insular)의 백질에도 병변이 나타날 수 있으며 미세출혈이 약 절반에서 동반되지만 조영증강과 세포독성부종은 잘 동반되지 않는다고 한다[38].
출혈은 5-27%에서 발생한다[5,6,9,34]. Hefzy 등[17]의 체계적인 연구에 의하면 15%에서 출혈이 동반되었고 유형은 5 mm 미만의 점상출혈, 구(sulcus)의 거미막하출혈 또는 뇌실질혈종이 있었다. 이 가운데 점상출혈이 가장 많았고 한 환자에서 여러 종류의 출혈이 있는 경우도 있었다. 면역억제요법을 받고 있는 환자에서 출혈빈도가 높았는데 고형장기이식보다는 동종이형골수이식을 받은 환자에서 더 높았다. 항응고치료를 받는 환자에서 뇌출혈 발생빈도가 높았지만 혈압은 뇌출혈과 상관관계가 없었다.
감수성강조(susceptibility-weighted) 영상을 이용한 McKinney 등[43]의 연구에 의하면 65%에서 출혈이 있었고 T2*-기울기에코영상보다 민감도가 더 높았다. 점상출혈이 90%를 차지하였고 환자당 평균 3개의 점상출혈이 있었다. 점상출혈은 뇌부종의 정도, 세포독부종과 조영증강의 유무와 상관관계가 없었고 추적검사에서 변화가 없었다.
Bartynski 등[15]의 연구에 의하면 카테터혈관조영술에서는 9명 가운데 8명에서 이상이 있었고 MRA에서는 43명 가운데 30명(70%)에서 혈관의 불규칙한 확장과 수축이 중등도 이상 수준으로 나타났지만 추적 MRA를 했던 11명 가운데 9명은 혈관이 정상으로 회복되었다. 감염, 패혈증 또는 쇼크에 의한 PRES 환자를 대상으로 시행하였던 Bartynski 등[10]의 다른 연구에서는 급성기에 MRA를 하였던 10명 가운데 9명(90%)에서 혈관협착 혹은 말단 분지폐색이 있었다.
그러나 Fugate 등[6]의 연구에서는 MRA (32명), 컴퓨터단층혈관 조영술(1명), 카테터혈관조영술(4명)을 하였던 37명 가운데 혈관수축은 4명(11%), 말단부 분지폐색은 1명(2.7%), 국소 후대뇌동맥 협착은 1명(2.7%), 척추동맥박리는 1명(2.7%)에서 발견되었다. 이처럼 혈관촬영 결과는 연구마다 상당한 차이가 있었다. 혈관병은 시간이 경과하면서 임상증상과 MRI 결과가 호전되면 대부분 회복된다.
위험인자를 신속하게 찾은 후에 이를 교정하거나 원인 약물을 중단하는 것이 가장 중요하며 뇌부종의 악화와 후유증을 예방할 수 있다[1,2,4,6]. 상황에 따라 원인이 되는 면역억제제 혹은 항암제의 중단, 자간 또는 전자간 환자에서는 제왕절개를 통한 분만, 혈액투석이 필요할 수 있다. 만약 혈압이 높다면 즉시 혈압을 정상으로 낮추어야 하는데 산모는 혈압을 너무 많이 감소시키면 태반의 혈류가 감소될 수 있으므로 주의하여야 한다[44].
발작 혹은 뇌전증지속상태가 발생하면 즉시 항경련제를 투여하여 발작을 중단시켜야 한다. 산모에서 발작이 발생하면 마그네슘 황산(magnesium sulfate)을 투여하는 것이 좋다[44]. 발작이 발생하면 급성기에 항경련제를 투여하지만 증상과 MRI 병변이 좋아지면 항경련제를 중단하는 것이 바람직하다. 급성기를 지나면 항경련제를 중단하더라도 발작이 재발하는 경우는 드물고 뇌전증으로 이행하는 경우는 거의 없다고 한다[35]. 그러나 급성기를 지나서 발작이 재발하는 경우에는 장기간 항경련제치료가 필요하며 뇌출혈 혹은 뇌경색의 유무와 연관성이 있을 것으로 추정된다.
양쪽 소뇌에 걸친 광범위한 뇌부종에 의하여 뇌간이 압박되고 제4뇌실이 눌려서 수두증이 발생한 환자에서 뇌실문합과 개두술을 하였던 증례보고가 있다[36]. 내피세포를 활성화시키는 TNF-ɑ와 치밀이음부를 약화시켜 혈액-뇌 장벽에 손상을 유발하는 VEGF의 수용체를 억제하거나 항체를 투여하면 이러한 손상을 차단할 수 있을 것으로 추정된다[24]. 글루코코르티코이드는 혈관내피에 직접 작용하여 이를 안정시키고 혈관 투과성을 감소시키는 것으로 알려져 있다. PRES의 병변이 주로 혈관부종이고 혈관내피의 손상으로 발생하므로 스테로이드치료가 도움이 될 수 있지만 효과에 대한 임상연구가 없었고 일반적으로 추천하지 않는다.
원인질환을 치료하거나 유발약물을 중단하면 신경계 증상은 대부분 6-8일 이내에 회복된다[5,9]. 그러나 신속한 진단이 이루어지지 않아 치료가 지연되면 영구적인 후유증 혹은 사망을 초래할 수 있다. PRES 자체에 의한 사망은 드물고 다발기관부전의 유무와 정도 또는 원인질환에 의하여 결정된다. 환자의 20% 가량에서는 MRI에서 세포독부종이 관찰되고 약 10%에서는 뇌실질에 큰 혈종이 동반되는데 이러한 경우에는 신경계 후유증의 발생 위험성이 높다. 뇌출혈은 발작의 위험인자로 작용하기 때문에 발작의 위험성이 증가하는데 연구에 의하면 미세출혈이 동반된 환자의 5-8%에서는 다른 증상이 회복된 후에도 1개월 이상 발작의 위험성이 높은 것으로 나타났다.
독성백질뇌병증은 항암치료, 면역억제제, 약물남용, 환경독성물질, 감염에 의하여 뇌백질에 손상이 발생하는 질환이다[50]. PRES는 사이클로스포린과 타크로리무스 또는 항암제에 의하여 주로 발생하지만 독성백질뇌병증을 일으키는 많은 원인도 PRES를 유발할 수 있다. PRES에서는 혈관의 내피세포가 주로 손상되지만 독성백질뇌병증은 백질에 분포하는 소동맥이 주로 손상된다[7]. 이러한 차이로 인하여 PRES는 피질과 피질하백질의 손상이 먼저 발생하고 독성백질뇌병증은 심부백질에서 손상이 시작된다(Fig. 7)[51]. 독성백질뇌병증은 주로 세포독부종이 발생하기 때문에 PRES보다 예후가 나쁘다.
RCVS는 뇌혈관의 수축이 발생하는 가역비염증질환으로서 대부분 반복되는 벼락두통으로 발현하고 구역, 구토, 시각증상, 눈부심, 소리공포증이 흔히 동반되고 경련, 일시적인 신경계증상, 뇌졸중, 비동맥류성 거미막하출혈이 발생할 수 있다[52]. PRES를 일으키는 원인(자간, 폐혈쇼크, 면역글로불린, 수혈, 고칼슘혈증, 포르피린) 가운데 RCVS를 유발하는 것도 있다. RCVS 환자의 8-38%에서는 가역혈관부종이 나타나는데 대개 1개월 이내에 회복되지만 거미막하출혈, 뇌출혈 혹은 뇌경색과 동반되어 발생하는 경우가 많다(Fig. 8)[52,53]. 국제두통학회의 RCVS 진단기준에는 수축된 뇌혈관이 3개월 이내에 회복되어야 하는 것으로 명시되었으며 PRES와 비교하면 RCVS에서는 비동맥류성 거미막하출혈이 더 빈번하고 뇌혈관촬영에서 다발성 뇌혈관수축이 현저한 것으로 보고되었다. 이처럼 PRES와 RCVS의 유발요인, 가역혈관부종과 가역뇌혈관수축이 서로 동일하거나 유사한 부분이 많으므로 동일한 기전에 의하여 발생하는 스펙트럼질환으로 추정된다.
급성 뇌경색에 의한 병변은 세포독부종이지만 PRES는 주로 혈관부종이므로 감별에 어려움이 없다. 두정후두엽에 아급성 뇌경색이 양쪽에 발생하면 구분이 어려울 수 있지만 PRES에서는 세포독성부종이 병변 전체에 생기지 않고 일부분에 국한되기 때문에 대부분 감별이 가능하다. PRES에서는 후두엽의 정중앙 옆부분과 새발톱(calcarine) 부위는 잘 침범하지 않기 때문에 감별에 도움이 된다[1]. 증상에 대한 자세한 병력청취를 통하여 PRES의 증상을 확인하고 혈관촬영에서 동맥의 폐색과 추적 MRI에서 뇌연화 혹은 뇌위축을 확인함으로써 감별할 수 있다.
PRES에서는 세포독성부종이 작은 점 혹은 국소 이랑형태로 발생하고 FLAIR 영상과 비교하면 병변의 일부분에 지나지 않지만 HIE에서는 훨씬 심하고 광범위한 세포독성부종이 피질에 다발성으로 나타난다[7]. HIE에서는 후두엽뿐만 아니라 섬, 피각, 해마, 소뇌에도 세포독부종이 관찰된다.
교뇌를 침범하지만 다른 부위에 병변이 없는(central variant) PRES는 중심교뇌수초용해증과 감별이 필요하다(Fig. 5)[54]. 중심교뇌수초용해증에서 교뇌의 중심부가 침범되지만 바깥쪽은 보존되기 때문에 병변이 박쥐날개(bat-wing) 모양으로 나타나고 세포독부종과 조영증강이 일어날 수 있다(Fig. 9). 교뇌외수초용해증에서는 시상, 기저핵, 외측무릎체 또는 드물게 피질과 해마도 침범될 수 있으므로 역시 PRES와 구분하여야 한다. 저나트륨혈증을 빨리 교정하였거나, 전해질이상, 알코올중독, 심한 화상, 장기이식 또는 영양실조의 병력이 있는지 확인이 필요하다. 전해질이상 없이 PRES 유발요인이 있고 가벼운 의식저하와 교뇌의 경미한 혈관부종이 나타났다가 며칠 이내에 의식이 회복되고 혈관부종이 사라지는 경우에는 중심교뇌수초용해증보다는 PRES의 가능성이 높다[40].
대부분에서 뇌종양과 감별은 어렵지 않지만 한쪽에 발생하는 종양형태(tumefactive)의 PRES에서는 조영증강이 되지 않기 때문에 낮은 등급의 신경교종과 감별이 필요하다[7]. 뇌간의 신경교종은 급성으로 발병하지 않고 증상이 서서히 시작되며 젊은 나이에서 생기고 PRES의 원인질환이 없으며 증상이 호전되지 않고 악화된다.
PRES는 다양한 원인에 의하여 의식저하, 경련, 두통 또는 시각 증상이 발생하였다가 7일가량 지나면 회복되고 MRI에서 가역혈관부종이 나타나는 질환이다. 비전형적인 증례가 많이 있기 때문에 이를 고려하여야 한다. 혈관부종이 여러 부위에 나타나면서 전형적인 병변이 없는 경우에는 추적 MRI를 하고 임상경과를 주의깊게 확인하여 PRES를 감별하여야 한다. 아울러 PRES의 유발요인이 있는 경우에는 발생 가능성을 염두에 두고 PRES의 증상이 나타나면 즉시 MRI를 촬영하여야 한다. 향후 병태생리에 대한 연구가 활발히 이루어져 발생기전을 밝힘으로써 PRES에 의한 손상을 조기에 차단할 수 있을 것이다. 기존 영상기법뿐만 아니라 확산텐서영상, 확산텐서경로술(tractography)과 뇌관류영상에 대한 연구는 PRES의 병인, 진단 및 치료에 더 많은 도움을 줄 수 있을 것으로 예상된다.
REFERENCES
1. Hinchey J, Chaves C, Appignani B, Breen J, Pao L, Wang A, et al. A reversible posterior leukoencephalopathy syndrome. N Engl J Med 1996;334:494-500.


2. Casey SO, Sampaio RC, Michel E, Truwit CL. Posterior reversible encephalopathy syndrome: utility of fluid-attenuated inversion recovery MR imaging in the detection of cortical and subcortical lesions. AJNR Am J Neuroradiol 2000;21:1199-1206.

3. Covarrubias DJ, Luetmer PH, Campeau NG. Posterior reversible encephalopathy syndrome: prognostic utility of quantitative diffusion-weighted MR images. AJNR Am J Neuroradiol 2002;23:1038-1048.

4. Bartynski WS. Posterior reversible encephalopathy syndrome, part 1: fundamental imaging and clinical features. AJNR Am J Neuroradiol 2008;29:1036-1042.


5. Lee VH, Wijdicks EF, Manno EM, Rabinstein AA. Clinical spectrum of reversible posterior leukoencephalopathy syndrome. Arch Neurol 2008;65:205-210.


6. Fugate JE, Claassen DO, Cloft HJ, Kallmes DF, Kozak OS, Rabinstein AA. Posterior reversible encephalopathy syndrome: Associated clinical and radiologic findings. Mayo Clin Proc 2010;85:427-432.



7. Rykken JB, McKinney AM. Posterior reversible encephalopathy syndrome. Semin Ultrasound CT MRI 2014;35:118-135.

8. Bartynski WS, Boardman JF. Distinct imaging patterns and lesion distribution in posterior reversible encephalopathy syndrome. AJNR Am J Neuroradiol 2007;28:1320-1327.


9. Roth C, Ferbert A. Posterior reversible encephalopathy syndrome: long-term follow-up. J Neurol Neurosurg Psychiatry 2010;81:773-777.


10. Bartynski WS, Boardman JF, Zeigler ZR, Shadduck RK, Lister J. Posterior reversible encephalopathy syndrome in infection, sepsis, and shock. AJNR Am J Neuroradiol 2006;27:2179-2190.

11. Schwartz RB, Jones KM, Kalina P, Bajakian RL, Mantello MT, Garada B, et al. Hypertensive encephalopathy: Findings on CT, MR imaging, and SPECT imaging in 14 cases. AJR Am J Roentgenol 1992;159:379-383.


12. Ijima T, Kubota Y, Kuroiwa T, Sankawa H. Blood-brain barrier opening following transient reflex sympathetic hypertension. Acta Neurochir Suppl (Wien) 1994;60:142-144.


13. Sundt TM Jr. The cerebral autonomic nervous system. A proposed physiologic function and pathophysiologic response in subarachnoid hemorrhage and in focal cerebral ischemia. Mayo Clin Proc 1973;48:127-137.

14. Apollon KM, Robinson JN, Schwartz RB, Norwitz ER. Cortical blindness in severe preeclampsia: computed tomography, magnetic resonance imaging, and single-photon-emission computed tomography findings. Obstet Gynecol 2000;95:1017-1019.


15. Bartynski WS, Boardman JF. Catheter angiography, MR angiography, and MR perfusion in posterior reversible encephalopathy syndrome. AJNR Am J Neuroradiol 2008;29:447-455.


16. Bartynski WS. Posterior reversible encephalopathy syndrome, part 2: Controversies surrounding pathophysiology of vasogenic edema. AJNR Am J Neuroradiol 2008;29:1043-1049.


17. Hefzy HM, Bartynski WS, Boardman JF, Lacomis D. Hemorrhage in posterior reversible encephalopathy syndrome: Imaging and clinical features. AJNR Am J Neuroradiol 2009;30:1371-1379.


18. Brubaker LM, Smith JK, Lee YZ, Lin W, Castillo M. Hemodynamic and permeability changes in posterior reversible encephalopathy syndrome measured by dynamic susceptibility perfusion-weighted MR imaging. AJNR Am J Neuroradiol 2005;26:825-830.

19. Byrom F. The pathogenesis of hypertensive encephalopathy and its relation to the malignant phase of hypertension; experimental evidence from the hypertensive rat. Lancet 1954;267:201-211.


20. Matsuda Y, Tomosugi T, Maeda Y, Kamitomo M, Kanayama N, Terao T. Cerebral magnetic resonance angiographic findings in severe preeclampsia. Gynecol Obstet Invest 1995;40:249-252.


21. Maemura K, Kurihara H, Morita T, Oh-hashi Y, Yazaki Y. Production of endothelin-1 in vascular endothelial cells is regulated by factors associated with vascular injury. Gerontology 1992;38(suppl 1):29-35.


22. Marsden PA, Brenner BM. Transcriptional regulation of the endothelin-1 gene by TNF-alpha. Am J Physiol 1992;262(4 Pt 1):C854-C861.

23. Dekker GA, Sibai BM. Etiology and pathogenesis of preeclampsia: current concepts. Am J Obstet Gynecol 1998;179:1359-1375.


24. Marra A, Vargas M, Striano P, Del Guercio L, Buonanno P, Servillo G. Posterior reversible encephalopathy syndrome: The endothelial hypotheses. Med Hypotheses 2014;82:619-622.


25. Horbinski C, Bartynski WS, Carson-Walter E, Hamilton RL, Tan HP, Cheng S. Reversible encephalopathy after cardiac transplantation: histologic evidence of endothelial activation, T-cell specific trafficking, and vascular endothelial growth factor expression. AJNR Am J Neuroradiol 2009;30:588-590.


26. Pizzolato GP, Sztajzel R, Burkhardt K, Megret M, Borisch B. Cerebral vasculitis during FK 506 treatment in a liver transplant patient. Neurology 1998;50:1154-1157.


27. Koide T, Yamada M, Takahashi T, Igarashi S, Masuko M, Furukawa T, et al. Cyclosporine A-associated fatal central nervous system angiopathy in a bone marrow transplant recipient: an autopsy case. Acta Neuropathol 2000;99:680-684.


28. Schwartz RB, Feske SK, Polak JF, DeGirolami U, Iaia A, Beckner KM, et al. Preeclampsia-eclampsia: clinical and neuroradiographic correlates and insights into the pathogenesis of hypertensive encephalopathy. Radiology 2000;217:371-376.


29. Demirtas O, Gelal F, Vidinli BD, Demirtas LO, Uluc E, Baloglu A. Cranial MR imaging with clinical correlation in preeclampsia and eclampsia. Diagn Interv Radiol 2005;11:189-194.

30. Vargas M, Servillo G, Striano P. Serum lactate dehydrogenase as early marker of posterior reversible encephalopathy syndrome: keep your eyes open. Anaesth Intensive Care 2012;40:570-571.

31. Finocchi V, Bozzao A, Bonamini M, Ferrante M, Romano A, Colonnese C, et al. Magnetic resonance imaging in Posterior Reversible Encephalopathy Syndrome: report of three cases and review of literature. Arch Gynecol Obstet 2005;71:79-85.

32. Ni J, Zhou LX, Hao HL, Liu Q, Yao M, Li ML, et al. The clinical and radiological spectrum of posterior reversible encephalopathy syndrome: a retrospective series of 24 patients. J Neuroimaging 2011;21:219-224.


33. Onder AM, Lopez R, Teomete U, Francoeur D, Bhatia R, Knowbi O, et al. Posterior reversible encephalopathy syndrome in the pediatric renal population. Pediatr Nephrol 2007;22:1921-1929.


34. Donmez FY, Basaran C, Kayahan Ulu EM, Yildirim M, Coskun M. MRI features of posterior reversible encephalopathy syndrome in 33 patients. J Neuroimaging 2010;20:22-28.


35. Kastrup O, Gerwig M, Frings M, Diener HC. Posterior reversible encephalopathy syndrome (PRES): electroencephalographic findings and seizure patterns. J Neurol 2012;259:1383-1389.


36. Grossbach AJ, Abel TJ, Hodis B, Wassef SN, Greenlee JD. Hypertensive posterior reversible encephalopathy syndrome causing posterior fossa edema and hydrocephalus. J Clin Neurosci 2014;21:207-211.


37. Mueller-Mang C, Mang T, Pirker A, Klein K, Prchla C, Prayer D. Posterior reversible encephalopathy syndrome: do predisposing risk factors make a difference in MRI appearance? Neuroradiology 2009;51:373-383.


38. McKinney AM, Jagadeesan BD, Truwit CL. Central-variant posterior reversible encephalopathy syndrome: brain-stem or basal ganglia involvement lacking cortical or subcortical cerebral edema. AJR Am J Roentgenol 2013;201:631-638.


39. de Seze J, Mastain B, Stojkovic T, Ferriby D, Pruvo JP, Destee A, et al. Unusual MR findings of the brain stem in arterial hypertension. AJNR Am J Neuroradiol 2000;21:391-394.

40. Casey SO, Truwit CL. Pontine reversible edema: a newly recognized imaging variant of hypertensive encephalopathy? AJNR Am J Neuroradiol 2000;21:243-245.

41. Ahn KJ, You WJ, Jeong SL, Lee JW, Kim BS, Lee JH, et al. Atypical manifestations of reversible posterior leukoencephalopathy syndrome: findings on diffusion imaging and ADC mapping. Neuroradiology 2004;46:978-983.


42. Bhagavati S, Choi J. Atypical cases of posterior reversible encephalopathy syndrome. Clinical and MRI features. Cerebrovasc Dis 2008;26:564-566.


43. McKinney AM, Sarikaya B, Gustafson C, Truwit CL. Detection of microhemorrhage in posterior reversible encephalopathy syndrome using susceptibility-weighted imaging. AJNR Am J Neuroradiol 2012;33:896-903.


44. O’Hara McCoy H. Posterior reversible encephalopathy syndrome: an emerging clinical entity in adult, pediatric and obstetric critical care. J Am Acad Nurse Pract 2008;20:100-106.


45. Sweany JM, Bartynski WS, Boardman JF. “Recurrent” posterior reversible encephalopathy syndrome: report of 3 cases-PRES can strike twice! J Comput Assist Tomogr 2007;31:148-156.


46. Daniel NJ, Hernandez CL, Walker RA. Recurrent posterior reversible encephalopathy syndrome in a pediatric patient with end-stage renal disease. J Emerg Med 2013;46:e39-e42.


47. Ergun T, Lakadamyali H, Yilmaz A. Recurrent posterior reversible encephalopathy syndrome in a hypertensive patient with end-stage renal disease. Diagn Interv Radiol 2008;14:182-185.

48. Chang OH, Stanculescu A, Dola C, Rothwell WB. Recurrent posterior reversible encephalopathy syndrome potentially related to AIDS and end-stage renal disease: a case report and review of the literature. Case Rep Med 2012;2012:914035.



49. Lazarus M, Amundson S, Belani R. An association between bevacizumab and recurrent posterior reversible encephalopathy syndrome in a patient presenting with deep vein thrombosis: A case report and review of the literature. Case Rep Oncol Med 2012;2012:819546.



51. McKinney AM, Kieffer SA, Paylor RT, SantaCruz KS, Kendi A, Lucato L. Acute toxic leukoencephalopathy: potential for reversibility clinically and on MRI with diffusion- weighted and FLAIR imaging. AJR Am J Roentgenol 2009;193:192-206.


53. Singhal AB, Hajj-Ali RA, Topcuoglu MA, Fok J, Bena J, Yang D, et al. Reversible cerebral vasoconstriction syndromes: analysis of 139 cases. Arch Neurol 2011;68:1005-1012.


54. Gamanagatti S, Subramanian S. Hypertensive encephalopathy: isolated pons involvement mimicking central pontine myelinolysis. Korean J Radiol 2006;7:218-219.



Figure 1.
Molecular basis of endothelial damage in PRES. PRES-related conditions cause the activation of the immune system and the release of cytokines such as TNF-a and IL-1. TNF-a and IL-1 induce the expression of the adhesion molecules ICAM-1 and VCAM-1 which interact with leukocytes, making them produce ROS and proteases leading to endothelial damage and consequent fluid leakage. TNF-a and IL-1 can also induce astrocytes production of VEGF which weakens the tight junction of brain vasculature and activates the VVO, thus contributing to edema formation (This figure was kindly provided by Dr. Marra A). PRES; posterior reversible encephalopathy syndrome, TNF; tumor necrosis factor, IL; interleukin; ICAM; intercellular adhesion molecule, VCAM; vascular cell adhesion molecule, ROS; reactive oxygen species, VVO; Vesiculo-Vacuolar Organelle, VEGF; vascular endothelial growth factor.
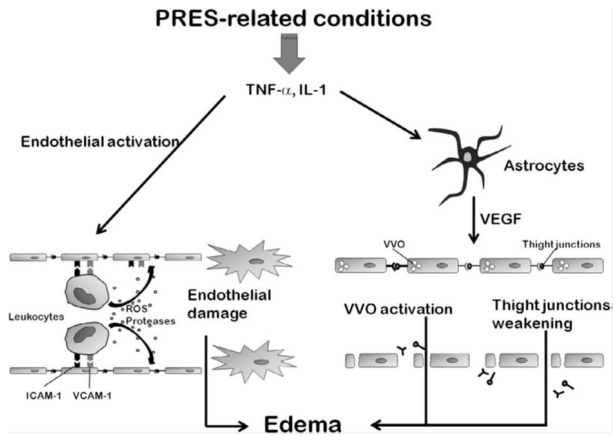
Figure 2.
Typical “Parietal-occipital” pattern of PRES. FLAIR images (A) and DWI (B), and ADC maps (C) demonstrate vasogenic edema in the cortex and subcortical white matter of the parietal and occipital lobes. There is slight leptomeningeal enhancement in the posterior area (D). PRES; posterior reversible encephalopathy syndrome, FLAIR; fluid attenuation inversion-recovery, DWI; diffusion weighted images, ADC; apparent diffusion coefficient.
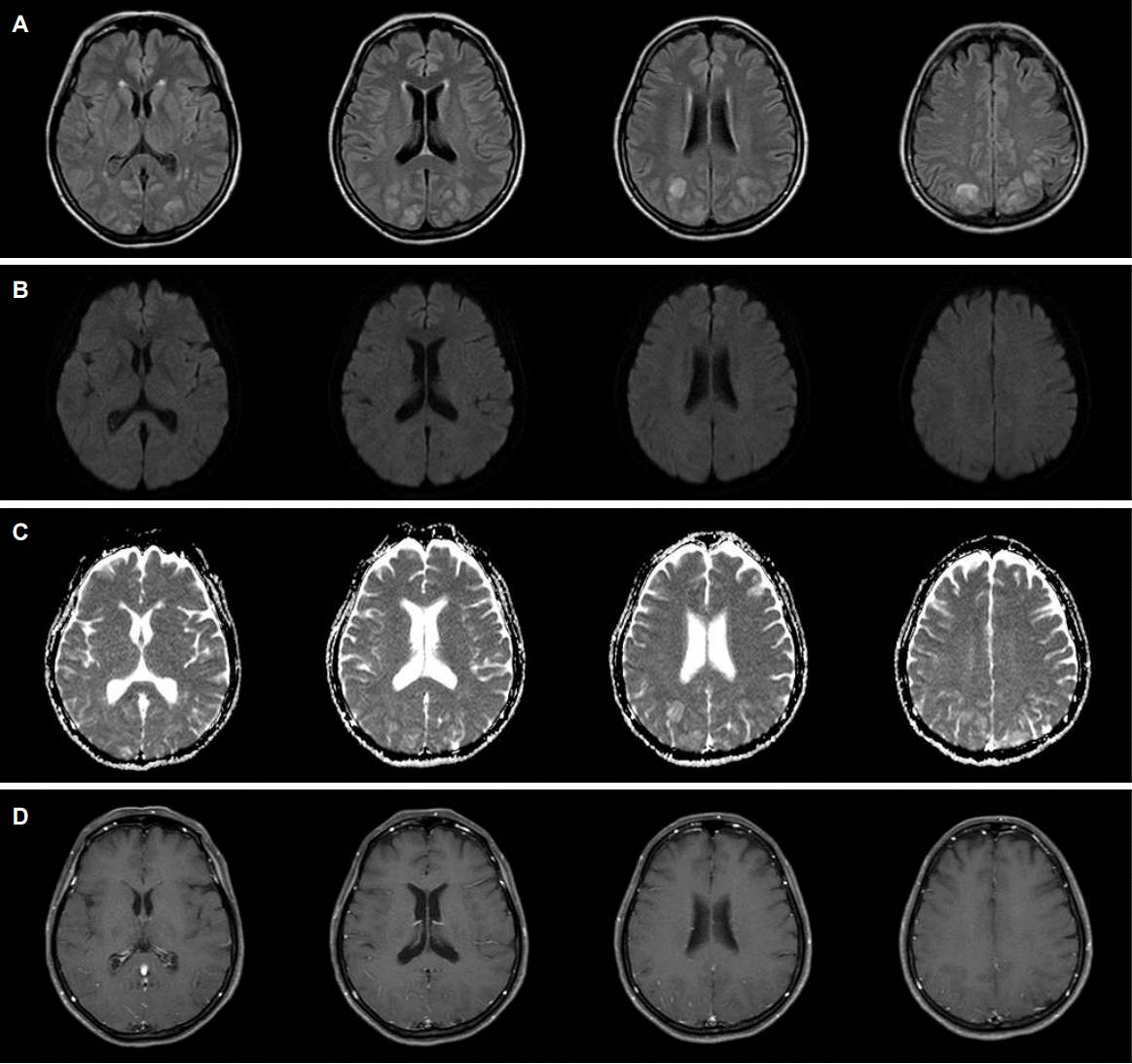
Figure 3.
“Superior frontal sulcus” pattern of PRES. FLAIR images demonstrate high signal intensity lesions involving the cortex and subcortical white matter of the frontal and parietal lobes extending along the middle and posterior portions of the superior frontal sulci. PRES; posterior reversible encephalopathy syndrome, FLAIR; fluid attenuation inversion-recovery.
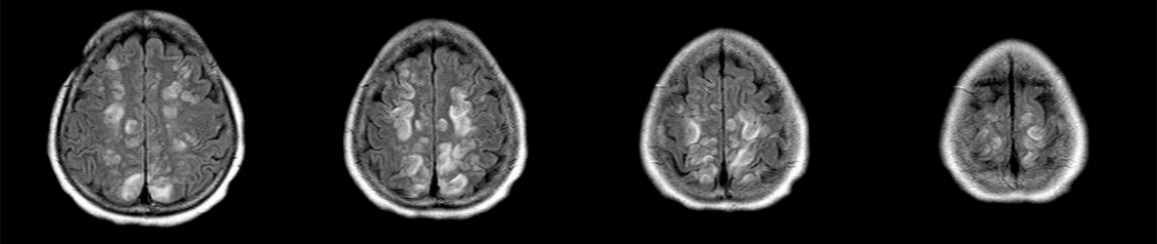
Figure 4.
“Holohemispheric” pattern of PRES. FLAIR images demonstrate high signal intensity lesions in the frontal, parietal, and occipital lobes, with lesser involvement of the temporal lobes. The anterior poles of the frontal lobes are spared. PRES; posterior reversible encephalopathy syndrome, FLAIR; fluid attenuation inversion-recovery.
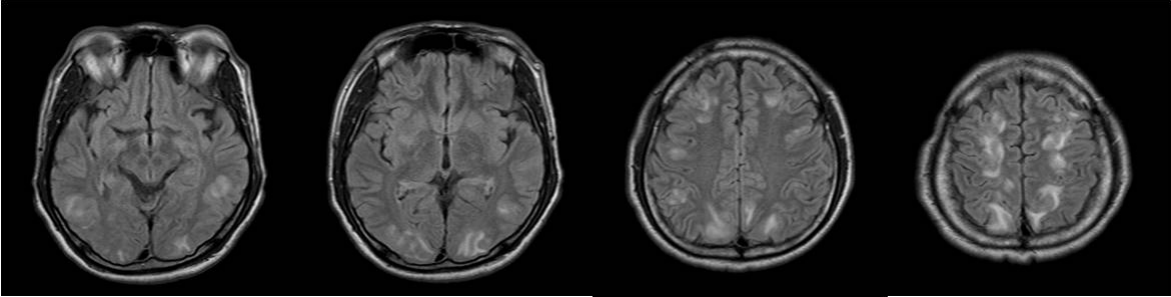
Figure 5.
“Central-variant” pattern of PRES. A 80-year-old man presented with altered mental status, acute pyelonephritis, and recent history of mild head trauma. FLAIR images (A) and DWI (B) show vasogenic edema in the bilateral pons, cerebellum, thalami, and basal ganglia with subdural hygroma and hemorrhage. Follow-up FLAIR imaging (C) at 7 days later shows almost resolution of the vasogenic edema and altered mental status of the patient recovered completely within 10 days. PRES; posterior reversible encephalopathy syndrome, FLAIR; fluid attenuation inversion-recovery, DWI; diffusion weighted images.
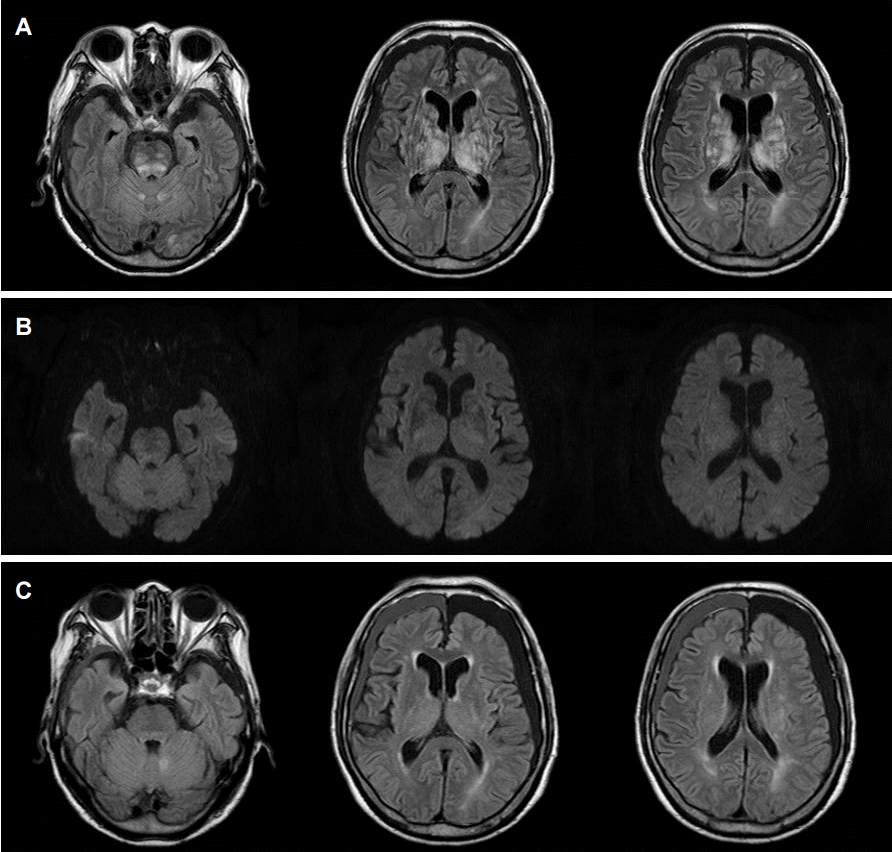
Figure 6.
“Severe” PRES. A 58-year-old woman, suffered from systemic lupus erythematosus, presented with seizures. FLAIR images (A, B) demonstrate extensive high signal intensity lesions involving the cortex, subcortical region, and deep white matter throughout much of both cerebral hemispheres. There is also vasogenic edema in the bilateral pons, basal ganglia, and cerebellar hemispheres. On a follow-up FLAIR imaging (C) performed 1 week later, most of the previous lesions were resolved. PRES; posterior reversible encephalopathy syndrome, FLAIR; fluid attenuation inversion-recovery.
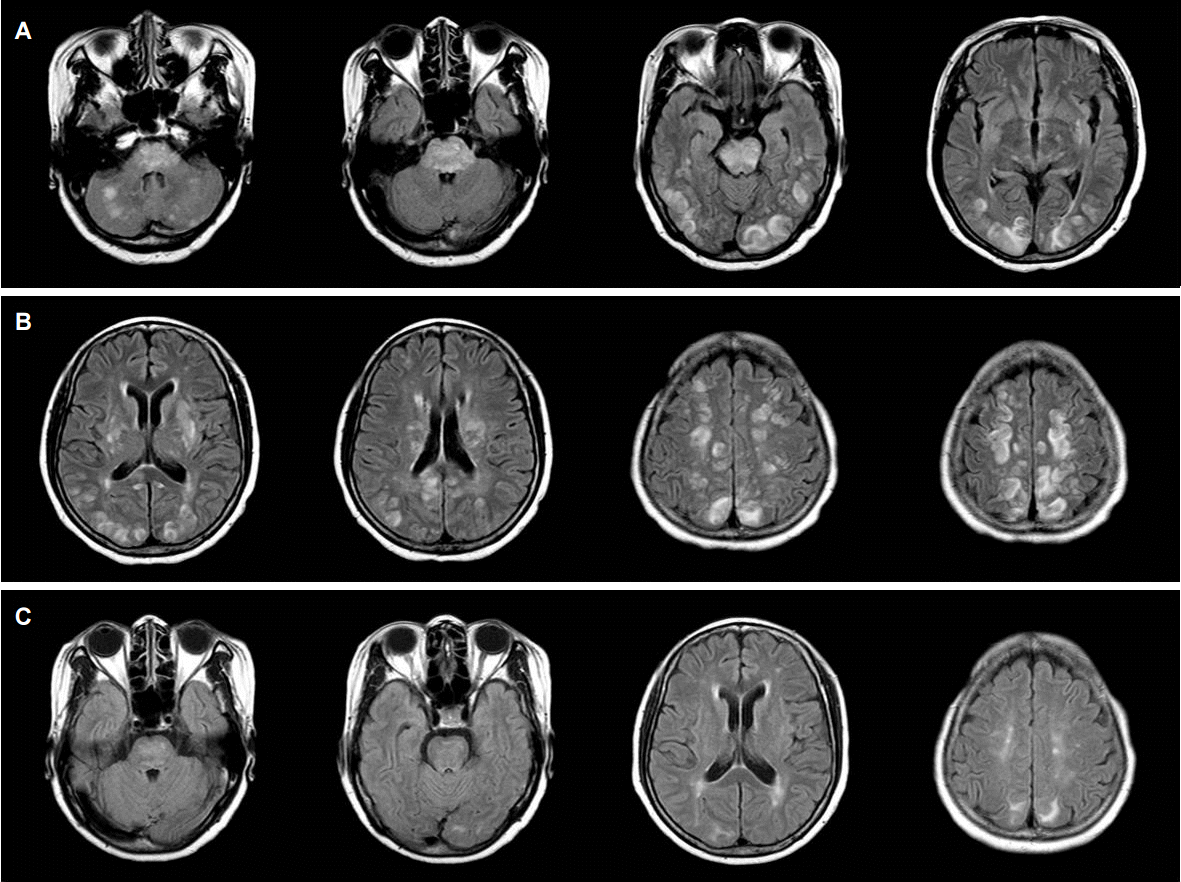
Figure 7.
MRI of acute toxic leukoencephalopathy. DWI (A), ADC maps (B), and FLAIR images (C) demonstrate abnormal cytotoxic edema in the bilateral deep white matter and corpus callosum symmetrically. On a follow-up DWI (D) and FLAIR images (E) performed 1 week later, all of the previous lesions except splenium of the corpus callosum were resolved. MRI; magnetic resonance imaging, DWI; diffusion weighted images, ADC; apparent diffusion coefficient, FLAIR; fluid attenuation inversion-recovery.
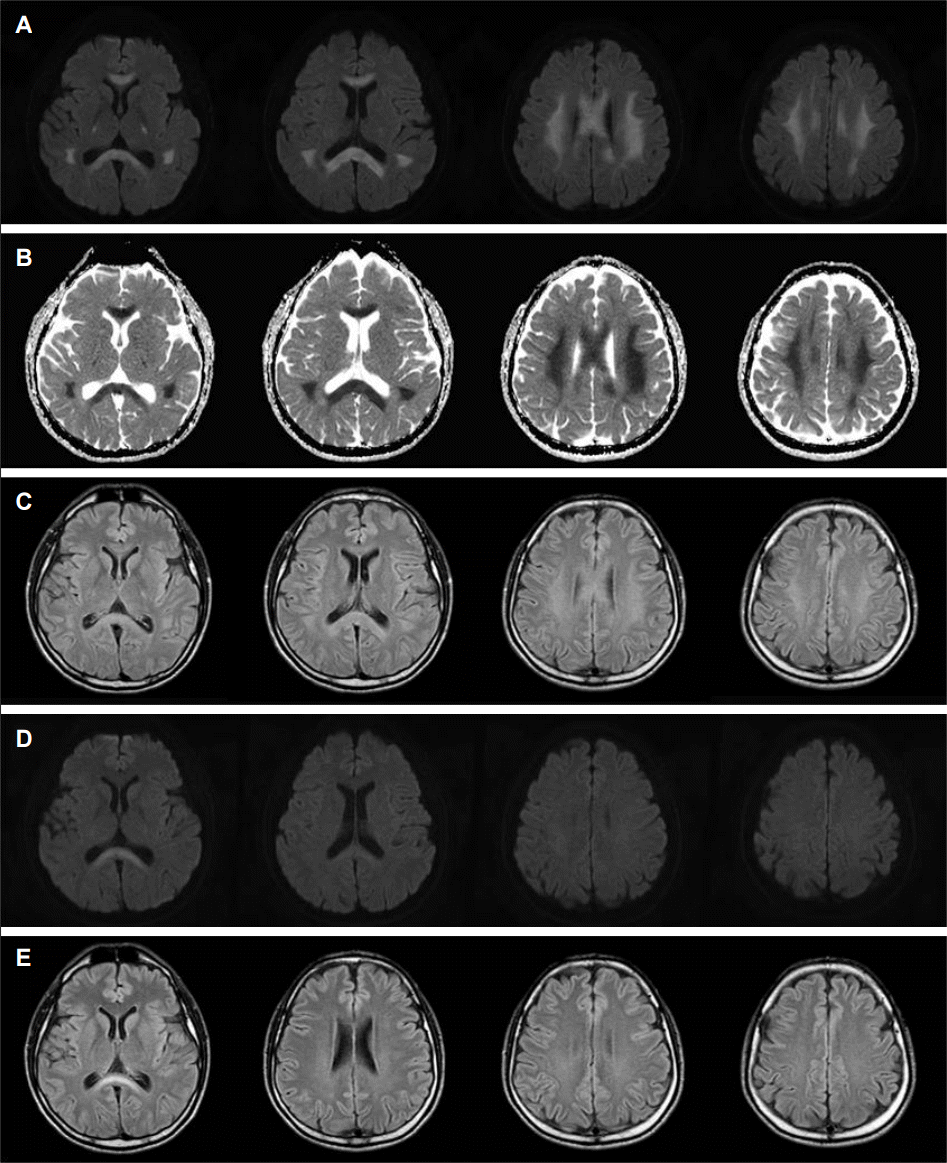
Figure 8.
MRI of reversible cerebral vasoconstriction syndrome. A 33-year-old woman presented with thunderclap headache, vomiting, weakness of right leg, and blindness. DWI (A) and ADC maps (B) demonstrate cytotoxic edema, consistent with infarcts, in the bilateral parieto-occipital regions. MRA (C) shows stenosis of the left anterior cerebral artery (long arrow) and multiple irregular constriction and dilatation of bilateral posterior cerebral arteries (short arrows). Follow-up MRI showed subacute stage of infarcts in the same area of (A) and (B), and MRA showed almost resolved state of arteries (not shown here). MRI; magnetic resonance imaging, DWI; diffusion weighted images, ADC; apparent diffusion coefficient, FLAIR; fluid attenuation inversion-recovery, MRA; magnetic resonance angiography.
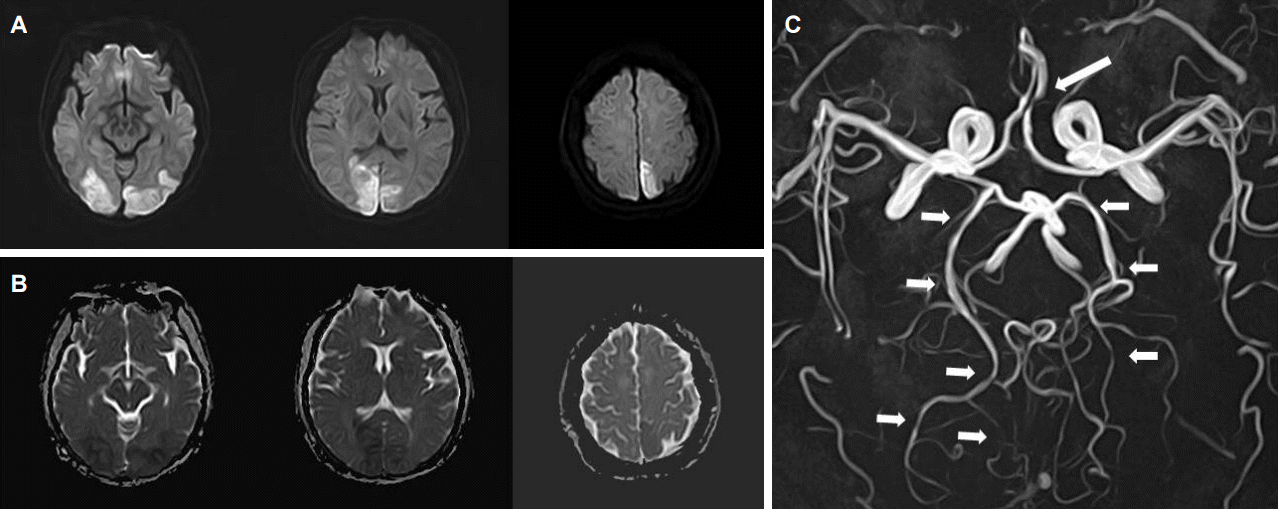
Figure 9.
MRI of central pontine myelinolysis. DWI (A) and FLAIR images (C) showing high signal intensity in the central pons with sparing of periphery. ADC maps (B) showing isosignal intensity and subtle low signal intensity in the same area of (A) and (C). MRI; magnetic resonance imaging, DWI; diffusion weighted images, FLAIR; fluid attenuation inversion-recovery.
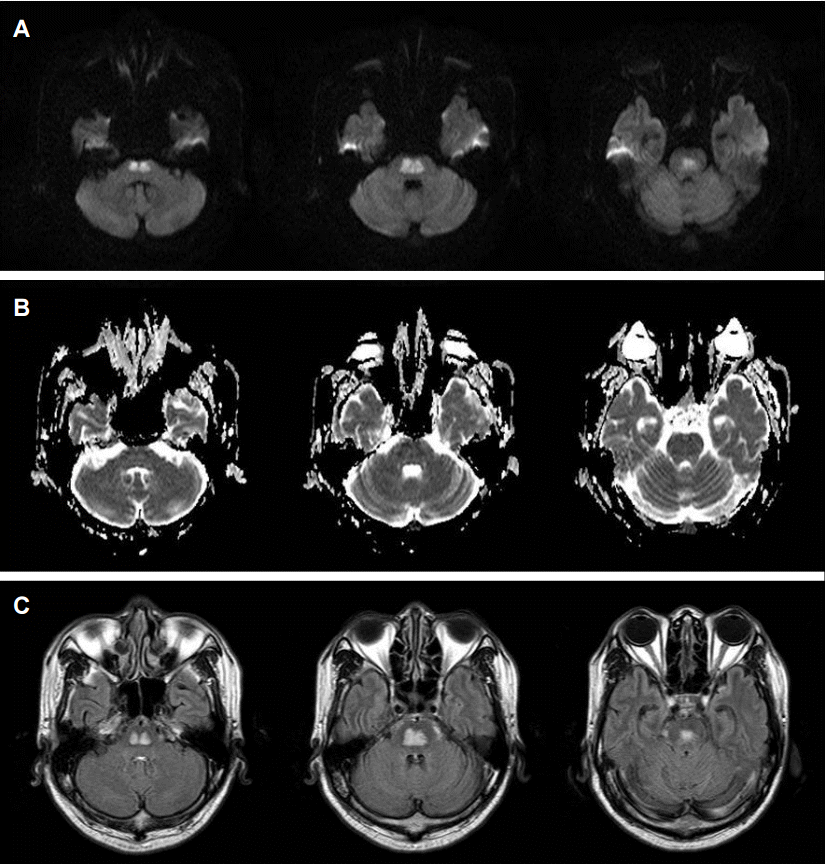
Table 1.
Conditions at risk for PRES
- TOOLS
-
METRICS

-
- 4 Crossref
- 0 Scopus
- 27,531 View
- 939 Download
- Related articles
-
Posterior Reversible Encephalopathy after Quetiapine Overdose2023 August;41(3)
Ceftriaxone- and Cephalexin-Induced Acute Reversible Encephalopathy2022 October;40(4)
Bilateral Hearing Loss in Wernicke Encephalopathy2019 August;37(3)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print



